Delta-like protein 3 (DLL3) als therapeutisches Target in kutanen Neoplasien

Abbildung 1: Wissenschaftliche Arbeitsgruppe der Universitätshautklinik: Nicklas Ballweg (Bachelor-Student), Antonia Becker (Master-Studentin), Marion Berthold (technische Assistentin), Dr. Valerie Glutsch (Funktionsoberärztin Hauttumorzentrum, Clinician Scientist), Dr. David Schrama (Biologe), Dr. Anja Gesierich (Oberärztin Hauttumorzentrum), Claudia Siedel (technische Assistentin) (v.l.n.r.).
Team
In der Arbeitsgruppe beschäftigen wir uns mit potenziell therapeutisch targetierbaren molekularen und biologischen Eigenschaften verschiedener kutaner Neoplasien. Ein besonderer Fokus liegt auf dem malignen Melanom und dem Merkelzellkarzinom. Basierend auf der Expression von Oberflächenantigenen untersuchen wir Möglichkeiten, die Therapieoptionen bei fortgeschrittenen Stadien dieser Erkrankungen zu optimieren und zu erweitern. Unter der Leitung von Frau Dr. med. Valerie Glutsch setzt sich das Team aus einem erfahrenen Biologen, klinisch tätigen ärztlichen KollegInnen, technischen Assistentinnen und Studierenden zusammen.
Motivation und Innovation
Als Funktionsoberärztin und Koordinatorin des Hauttumorzentrums der Würzburger Universitätshautklinik begleitet Frau Dr. Glutsch PatientInnen mit fortgeschrittenen dermatoonkologischen Erkrankungen. Trotz einer Revolution der Therapielandschaft durch die Zulassung immunonkologischer und zielgerichteter Therapien im Verlauf der letzten 15 Jahre zeigt ein nicht unerheblicher Anteil unserer Hautkrebs-PatientInnen eine primäre oder erworbene Resistenz gegenüber den zugelassenen Therapien. Als klinisch und wissenschaftlich tätige Ärztin hat Frau Dr. Glutsch ein besonderes Interesse an der Translation wissenschaftlicher Erkenntnisse in den klinischen Alltag, um langfristig zur Verbesserung bestehender und der Entwicklung zukünftiger Therapien beizutragen.
Die Stiftung „Forschung hilft“ zur Förderung der Krebsforschung an unserem Universitätsklinikum unterstützt neue, erfolgsversprechende Forschungsansätze zur Vorbeugung, Diagnose und Therapie von Krebs. Frau Valerie Glutsch und ihre Arbeitsgruppe wären dankbar, einen Beitrag dazu leisten zu dürfen.
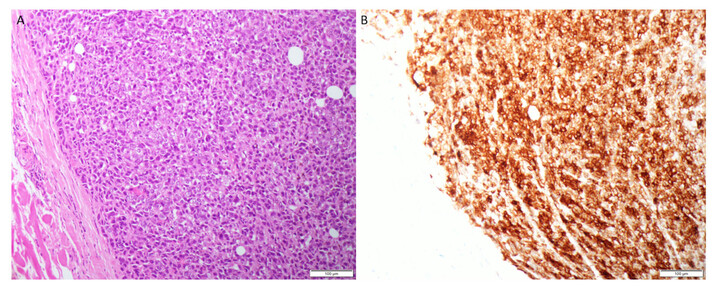
Abbilung 2: Immunhistochemischer Nachweis von DLL3 in einer Lymphknotenmetastase eines rektalen Schleimhautmelanoms. A) Hämatoxylin-Eosin-Färbung, x20. B) DLL3-Immunhistochemie (Ventana-DLL3 (SP347) Assay) mit mäßig bis kräftiger, spezifischer (membranärer und zytoplasmatischer) Färbereaktion in 100% der Tumorzellen, x20. Fotos @Elena Gerhard-Hartmann, Pathologisches Institut der Universität Würzburg.
Welche Ziele verfolgt das Projekt?
Der Notch-Signalweg ist ein weit verbreiteter, komplexer, multifunktioneller Signalübertragungsweg, der für viele physiologische Prozesse wie Zellkommunikation, Differenzierung, Wachstum und Entwicklung verantwortlich ist. Er setzt sich aus vier Notch Rezeptoren und fünf Liganden zusammen. In der Krebsforschung hat der Ligand DLL3 (Delta-like ligand 3) zunehmende Bedeutung erlangt, weil er auf gesunden Zellen in der Regel nur in sehr geringen Mengen bzw. vorrangig intrazellulär exprimiert wird. In verschiedenen Tumoren, insbesondere in kleinzelligen Lungenkarzinomen (SCLC), zeigt sich eine DLL3-Überexpression auf der Zellmembran, die als potenzielles Ziel für therapeutische Interventionen dienen kann (Abb. 3A). Da eine DLL3-(Über-)Expression vorrangig auf Krebszellen und insbesondere bei aggressiven Tumoren vorkommt, ist DLL3 somit ein attraktives pharmakologisches Ziel in der translationalen Krebsforschung. Die gezielte Blockierung von DLL3 bietet potenzielle therapeutische Optionen, die das Fortschreiten von Tumoren hemmen und möglicherweise das Überleben von Patienten verbessern können.
Tarlatamab ist ein sogenannter bispezifischer T-Zell-Engager (BiTER-Antikörper), der T-Zellen der PatientInnen unabhängig vom Antigen und vom Haupthistokompatibilitätskomplex (MHC) Klasse I gegen DLL3-exprimierende Krebszellen richtet. Tarlatamab bindet also sowohl an DLL3 auf Krebszellen als auch an CD3 auf T-Zellen, was zur T-Zell-vermittelten Lyse von Krebszellen führt (Abb. 3B). Das Medikament ist in den USA seit Mai 2024 für die Therapie des kleinzelligen Lungenkarzinoms zugelassen. Am Standort Würzburg besteht durch die federführende Teilnahme an einer Phase I-Studie (DeLLphi-300) mit Tarlatamab bereits Expertise in der Behandlung von KrebspatientInnen mit Tarlatamab (Dr. Horst-Dieter Hummel, Early Clinical Trial Unit (ECTU)).
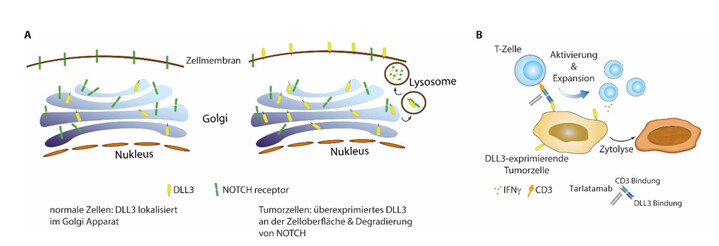
Abbilung 3: DLL3-Expression und Wirkmechanismus von Tarlatamab. A) Die DLL3 Expression ist in normalen Zellen vornehmlich auf den Golgi-Apparat beschränkt, in DLL3 überexprimierenden Tumorzellen kann es auch auf der Zellmembran detektiert werden und vermittelt in diesen Zellen meist den lysosomalen Abbau von Notch Rezeptoren. B) Tarlatamab ist ein bispezifischer T-Zell-Engager (BiTeR-Antikörper), der an CD3 auf T-Zellen und DLL3 auf Tumorzellen bindet und diese zusammenbringt. Nach erfolgter Bindung kommt es zu einer T-Zell-Proliferation und –Aktivierung sowie schlussendlich zum Tod der Tumorzellen.
Forschungsfrage: „Welche Rolle spielt DLL3 als therapeutisches Ziel in der Behandlung von kutanen Neoplasien?“
Diese Frage kann in mehrere Teilaspekte untergliedert werden:
- Mechanismen der Expression: Wie wird DLL3 in Melanomen und Merkelzellkarzinomen exprimiert und welche Rolle spielt die DLL3-Expression für das Tumorwachstum?
- Therapeutische Zielstrukturen: Ist DLL3 als potenzielle Zielstruktur für zielgerichtete Therapien (z.B. Tarlatamab) als Monotherapie oder in Kombinationsansätzen mit zugelassenen Therapien (Immuntherapien, zielgerichtete Therapie) geeignet?
Ansatz des Forschungsprojektes
Aus klinischen Studien zum kleinzelligen Lungenkarzinom wissen wir, dass Tarlatamab eine vielversprechende Wirksamkeit bei Tumoren mit DLL3-(Über-)Expression aufweist. Zudem gibt es in der Literatur erste Hinweise, das kutane Neoplasien – insbesondere das maligne Melanom und das Merkelzellkarzinom – DLL3 exprimieren. Wir werden DLL3-Expressionsanalysen auf unterschiedliche Subentitäten (z. B. Schleimhautmelanome) ausweiten und Tumorgewebe unserer PatientInnen mittels Immunhistochemie analysieren (hier besteht eine bereits gut etablierte Kooperation mit dem Institut für Pathologie der Universität Würzburg, PD Dr. Dr. Elena Gerhard-Hartmann). Zusätzlich planen wir, die DLL3-Expression in bei uns etablierten Zelllinien (von kutanen und mukosalen Melanomen, Aderhautmelanomen, Merkelzellkarzinomen) auf RNA- und Protein-Ebene (qPCR, Immunoblot) sowie hinsichtlich einer Expression auf der Zelloberfläche (Durchflusszytometrie, Immunhistochemie) zu untersuchen. Durch die Ausschaltung von DLL3 in Tumorzellen mittels der CRISPR/Cas-Technologie soll dessen Rolle mittels Viabilitäts- und Transkriptomsanalysen (RNAseq) untersucht werden. Schließlich wollen wir die Wirksamkeit des Medikaments Tarlatamab in den genannten Entitäten in 3D-Zellkulturen untersuchen. Dazu werden wir die Rekrutierung und Expansion von T-Zellen sowie die Viabilität der Tumorzellen in Kokultur unter Tarlatamab studieren. Zudem weisen viele Hauttumorzellen eine reduzierte Immunogenität durch verringerte Expression des Klasse I-Haupthistokompatibilitätskomplexes (MHC-I) auf (epigenetisches Silencing). Dies kann durch die Hinzugabe von Interferon revertiert werden. Daher möchten wir untersuchen wie ein Priming mit Tarlatamab und unspezifischen T-Zellen die MHC-I-Expression auf Hauttumorzellen und deren Immunogenität gegenüber tumorspezifischen T-Zellen beeinflusst.
Welche Krebserkrankung soll behandelt werden?
Kutane Neoplasien zählen zu den häufigsten Krebserkrankungen weltweit. Insbesondere das maligne Melanom und das Merkelzellkarzinom neigen zur Ausbildung von Metastasen und bedingen eine erhebliche Morbidität und Mortalität. Die Behandlung hängt bei beiden Entitäten vom Krankheitsstadium ab. In lokal fortgeschrittenen und metastasierten Stadien kommen verschiedene Systemtherapien – vorranging immunonkologische Ansätze bzw. beim malignen Melanom zusätzlich zielgerichtete Therapien – zum Einsatz. Die Prognose ist dabei maßgeblich von einem Ansprechen auf die immunonkologischen Therapieansätze abhängig. Bei primärer oder erworbener Resistenz gegenüber diesen Therapien stehen bisher wenig bis keine (in Abhängigkeit von der Entität) evidenzbasierten, zugelassenen und (langfristig) effizienten Therapieoptionen zur Verfügung. Insbesondere für das mukosale Melanom und das Merkelzellkarzinom fehlen effiziente Systemtherapien nach Versagen einer immunonkologischen Therapie.
Warum soll das Forschungsprojekt unterstützt werden?
Durch immunonkologische und zielgerichtete Therapien können wir aktuell viele unserer PatientInnen mit fortgeschrittenen oder metastasierten Hautkrebserkrankungen erfolgreich therapieren. Dennoch besteht für Melanom- und Merkelzellkarzinom-PatientInnen mit primärer oder erworbener Resistenz gegenüber den zugelassenen Therapien ein dringlicher Bedarf, neuartige therapeutische Ansätze zu erforschen. DLL3 ist aufgrund der Expression vorrangig auf der Oberfläche von Krebszellen ein idealer Angriffspunkt für eine zielgerichtete onkologische Therapie. Am Standort gibt es bereits im Rahmen von klinischen Studien sowie im Bereich des off-label use Erfahrungen mit dem gegen DLL3-gerichteten bispezifischen T-Zell-Engager Tarlatamab (bereits etablierte Kooperation mit Dr. Horst-Dieter Hummel, ECTU). Gerne möchten wir diese therapeutische Option für unsere Hautkrebs-PatientInnen validieren. Im vorgeschlagenen Projekt wollen wir für die genannte therapeutisch äußerst relevante Fragestellung zunächst grundlegende Untersuchungen hinsichtlich der Expression von DLL3 und der Wirksamkeit einer etwaigen Therapie in vitro durchführen. Unser langfristiges Ziel ist es, PatientInnen mit fortgeschrittenem Hautkrebs mit nachweisbarer DLL3-Expression nach Ausschöpfung zugelassener Therapien mit einer gegen DLL3-gerichteten Therapie als Monotherapie oder in Kombination mit einer Immuntherapie zu behandeln – idealerweise im Rahmen eines sogenannten Investigator-initiated Trial unter der Dachstruktur des Comprehensive Cancer Center (CCC) Mainfranken/CCC Allianz WERA und des Nationalen Centrums für Tumorerkrankungen (NCT) WERA.
