Der Rezeptor ROR2 - Angriffsziel für therapeutische Antikörper

Abbildung 1: Das Team der AG Lang
Team
Die Arbeitsgruppe von Frau Dr. Isabell Lang beschäftigt sich mit dem spannenden und hoch aktuellen Thema der Entwicklung von „Therapeutischen Fusionsproteinen und Antikörpern“. Ziel ist es spezielle Signalmoleküle, sogenannte Rezeptoren, zu nutzen, um Tumorzellen gezielt zu bekämpfen. Dafür werden spezielle Proteine entwickelt, die mit eben diesen Rezeptoren interagieren und diese spezifisch im Tumor bzw. in der Tumorumgebung aktivieren. Die AG Lang ist der Abteilung für Molekulare Innere Medizin (Leitung Prof. Dr. Wajant) zugeordnet und setzt sich international aus promovierten Biologen, medizinischen und naturwissenschaftlichen Doktoranden, sowie technischen Assistenten zusammen.
Motivation und Innovation
Unsere größte Motivation liegt darin wissenschaftliche Erkenntnisse zu nutzen, um die Therapie von Krebspatienten effektiver und sicherer zu machen. Erreichen können wir das, indem wir die Nebenwirkungen einer Immuntherapie minimieren, d.h. wir streben die Entwicklung hoch aktiver Wirkstoffe an, die gezielt im Tumor bzw. im Tumormikromilieu Rezeptoren aktivieren und so Immunzellen im Tumorareal zur Bekämpfung der Krebszellen zu stimulieren. Für die Weiterentwicklung und Optimierung unserer therapeutischen Konstrukte sind wir immer auf der Suche nach weiteren Zielstrukturen, die sich im Tumor oder der Tumorumgebung befinden und auf gesunden Zellen nicht oder nur in geringen Mengen vorkommen. Außerdem ist es wichtig, dass die adressierten Zielstrukturen wichtig für den Tumor sind, so dass diese vom Tumor nicht einfach runterreguliert werden können. Die Expertise unserer Arbeitsgruppe liegt in der Entwicklung und Herstellung neuartiger multispezifscher IgG/Fc-Nanobody-Fusionsproteine mit verstärkten Immuneffektorfunktionen, die solche Zielstrukturen als Angriffspunkt nutzen.

Abbildung 2: Das Team bei der Entwicklung neuer therapeutischer Fusionsproteine.
Welche Ziele verfolgt das Projekt?
Wir möchten den Rezeptor ROR2 als weiteres „taktisches“ Angriffsziel für unsere therapeutischen Antikörper-Fusionsproteine nutzen. Daher werden wir multispezifische Konstrukte generieren und testen, die Domänen enthalten, die ROR2 erkennen und darüberhinaus über eine oder mehrere Domänen verfügen, die auf Rezeptoren der TNF-Rezeptor-Superfamilie abzielen. TNF-Rezeptoren sind Signalmoleküle des Immunsystems und haben oft eine stark immunstimulierende Wirkung, die man sich gerne tumortherapeutisch nutzbar machen würde. Eine Aktivierung von TNF-Rezeptoren im ganzen Körper ist allerdings sehr gefährlich. Es muss daher das Ziel sein, diese Rezeptoren nur oder doch zumindest mit hoher Präferenz im Tumorareal zu stimulieren. Wir arbeiten nun an Molekülen, die genau eine solche tumorlokalisierte Aktivierung ermöglichen sollen.
Ansatz des Forschungsprojektes
Der Rezeptor ROR2 (Orphan Tyrosine Kinase Receptor 2) gehört zur Familie der Rezeptor-Tyrosinkinasen und wird mit Prozessen in Verbindung gebracht, die sowohl das Tumorwachstum fördern als auch eine Therapieresistenz hervorrufen. Der Umstand, dass ROR2 im adulten Gewebe weitestgehend fehlt, aber bei verschiedenen Krebsarten, wie z.B. dem Multiplen Myelom (MM), Brust- oder Bauchspeicheldrüsenkrebs überexprimiert wird, macht diesen Rezeptor als neue potentielle therapeutische Zielstruktur äußerst attraktiv. Es ist bekannt, dass die Expression von ROR2 mit der Tumorinvasivität und der Metastasierung korreliert, so dass ROR2 auch als Prognosemarker in Betracht gezogen werden kann. ROR2 ist ein Typ I Transmembranprotein, d.h. der Rezeptor befindet sich an der Zelloberfläche und ist somit ein exzellentes Ziel für Antikörper-Fusionsproteine.
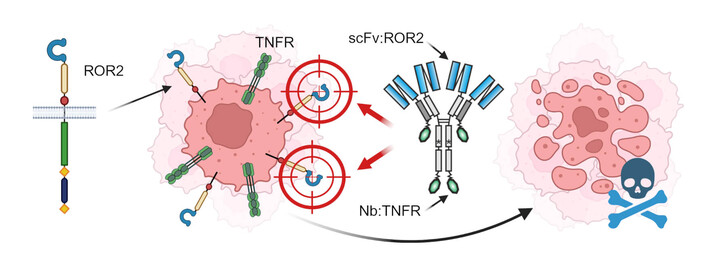
Abbildung 3: Der Rezeptor ROR2 ist auf vielen Krebsarten vorhanden und somit ein taktisch kluges Angriffsziel. Zum einen als „Anker“ für neue konditional aktive therapeutische Antikörper-Fusionsproteine, die auf Mitglieder der TNF-Rezeptor(TNFR)-Superfamilie abzielen und zum anderen als direktes Target für blockierende Antikörper. (scFv: single chain variable fragment, Nb: Nanobody)
Der Ansatz unseres Forschungsprojektes ist es ROR2 als neues bzw. weiteres Target unserer therapeutischen Fusionsproteine zu nutzen. Daher werden wir Domänen (zunächst scFvs) in unsere neuartigen multispezifischen Antikörper-Fusionsproteine integrieren, die ROR2 als „Anker“ auf Krebszellen nutzen. Nur wenn unsere Proteine zusätzlich an diesen „Anker“ gebunden haben, können sie spezifisch im Tumor ihre Aktivität über Effektor-Rezeptoren (z.B. Mitglieder der TNF-Rezeptor-Superfamilie) entfalten. Wir konnten bereits an Beispielen belegen, dass derartige Fusionsproteine konditional hoch aktiv sind und wir versprechen uns geringere Nebenwirkungen der Therapeutika, da sie lokal im Tumor bzw. in der Tumormikroumgebung wirken.
Ein weiterer Ansatz ist ROR2 nicht nur als „Anker“ zu nutzen, sondern auch über blockierende Antikörper-Domänen als direktes Ziel anzugreifen. Es wurde beispielsweise im Multiplen Myelom gezeigt, dass ROR2 die Interaktion von MM-Zellen mit dem umgebenden Knochenmark vermittelt. Diese Interaktion ist für das Überleben der MM-Zellen entscheidend. Der Ligand von ROR2, Wnt5a, ist außerdem der am häufigsten vorkommende Wachstumsfaktor im Knochenmark von MM-Patienten. In vivo Modelle haben gezeigt, dass die Blockade von ROR2 und somit die Unterbrechung der Interaktion Knochenmark/MM die MM-Zellen aus ihrer Nische, d.h. ihrer „Wohlfühlumgebung“, herauslockt und zu deren Zelltod führt. Kürzlich wurde auch beschrieben, dass die Blockade von ROR2 bei Brustkrebs einen Rückfall nach erfolgreicher Therapie verhindern kann, indem „stammzellähnliche“ Eigenschaften der verbleibenden Zellen unterdrückt werden. Diese Befunde möchten wir uns zu Nutze machen und ROR2 als Angriffsziel in unsere multispezifischen Fusionsproteine integrieren, um mit nur einem Molekül gleichzeitig mehrere Immuneffektorfunktionen in direkter Tumorumgebung auslösen zu können.
Welche Krebserkrankung soll behandelt werden?
ROR2 ist bei diversen Krebsarten überexprimiert. Dank unserer multispezifischen Antikörper-Fusionsproteine sind wir in der Lage kontextabhängige Fragestellungen zu bearbeiten, wodurch unser Forschungsansatz für die unterschiedlichsten Tumorentitäten eingesetzt und für viele Krebspatienten von Nutzen sein kann. Zu Beginn möchten wir uns auf das Multiple Myelom fokussieren.
Warum soll das Forschungsprojekt unterstützt werden?
Das beantragte Forschungsprojekt soll dabei helfen einen erfolgversprechenden immuntherapeutischen Ansatz, nämlich den Rezeptor ROR2 als Angriffsziel für Antikörper-Fusionsproteine zu nutzen, für die mögliche Anwendung im Krebspatienten zu evaluieren. Der Umstand, dass wir multispezifische Fusionsproteine entwickeln können, deren Wirkung lokal und spezifisch ist, lässt auf weniger Nebenwirkungen für die Patienten hoffen. Ein weiterer Vorteil ist, dass wir über ROR2 als Target verschiedenste Krebsarten angreifen können und wir in der Lage sind den Wirkstoff individuell an den jeweiligen Kontext anzupassen. Die Förderung des Forschungsprojekts soll den Grundstein legen für die Weiterentwicklung und Optimierung therapeutischer Antikörper mit ROR2 als Angriffs- bzw. Zielstruktur.
