Die Auswirkung der metastatischen Stoffwechsel-Nische auf das Wachstum von Brustkrebszellen
Dieses Projekt wurde 2024 von der Stiftung "Forschung hilft" mit 15.000 Euro gefördert.

Abbildung 1: Maximilian Krämer (Doktorand) und Angela Riedel (AG Leiterin) aus dem Mildred-Scheel-Nachwuchszentrum für Krebsforschung (UKW)
Team
Die Arbeitsgruppe von Dr. Angela Riedel am Mildred-Scheel-Nachwuchszentrum für Krebsforschung (UKW) beschäftigt sich mit der zellulären Kommunikation von Krebszellen innerhalb ihrer Nische – also ihrer unmittelbaren Umgebung.
In diesem Projekt untersuchen die Nachwuchswissenschaftler:innen Greta Mattavelli (Doktorandin, AG Riedel) und Maximilian Krämer (Doktorand, AG Riedel) die Zusammensetzung von Gewebeflüssigkeiten von Krebspatientinnen und Modellen im Krankheitsverlauf, um Stoffwechsel-(Metabolismus)-veränderungen während der Metastasierung nachzuvollziehen. Dabei arbeitet das internationale Team eng mit der Frauenklinik des UKW unter der Leitung von Prof. Dr. med. Achim Wöckel zusammen. Durch den intensiven Austausch mit den Medizinern der Klinik haben wir die einzigartige Möglichkeit, unsere Ergebnisse translational zu diskutieren.
Motivation und Innovation
Brustkrebs ist weltweit die häufigste Krebserkrankung bei Frauen und betrifft etwa jede neunte Frau. Brustkrebs ist eine sehr vielgestaltige Erkrankung, die in verschiedene klinische Unterformen (Subtypen) unterteilt werden kann, die sich in ihrer Aggressivität und ihrem Potenzial zur Metastasierung unterscheiden. Ein Drittel aller Patientinnen entwickelt im Verlauf der Erkrankung Metastasen in entfernten Organen wie Knochen oder Lunge, die manchmal erst viele Jahre nach der Erstdiagnose und/oder -behandlung auftreten. Bis heute sind die biologischen Mechanismen, die der Ansiedlung und dem Erwachen von ruhenden Tumorzellen in entfernten Organen zugrunde liegen, nur unzureichend verstanden.
Wir vermuten, dass verschiedene Stoffwechsel-(Metabolismus)-produkte - d.h. welche Nahrung der Tumorzelle angeboten wird - dereguliert sind und die Ansiedlung und das Erwachen von Tumorzellen begünstigen können. Wir versuchen daher, den Stoffwechsel während des Krankheitsverlaufs zu verstehen und mögliche Angriffspunkte für neue Therapien gegen Metastasen und Rezidive zu identifizieren.
Welche Ziele verfolgt das Projekt?
Wir wollen verstehen, wie sich der Stoffwechsel während der Metastasierung verändert und warum Krebszellen in bestimmten Organen wachsen, in anderen aber nicht. Langfristig soll dies helfen zu verstehen, warum Krebszellen oft jahrelang ‚ruhen‘, also eine Art Winterschlaf machen, und dann wieder zu wachsen beginnen. Wir sind davon überzeugt, dass die Stoffwechsel-Nische, also das, was den Krebszellen als ‚Nahrung‘ zur Verfügung steht, eine wichtige Rolle spielt.
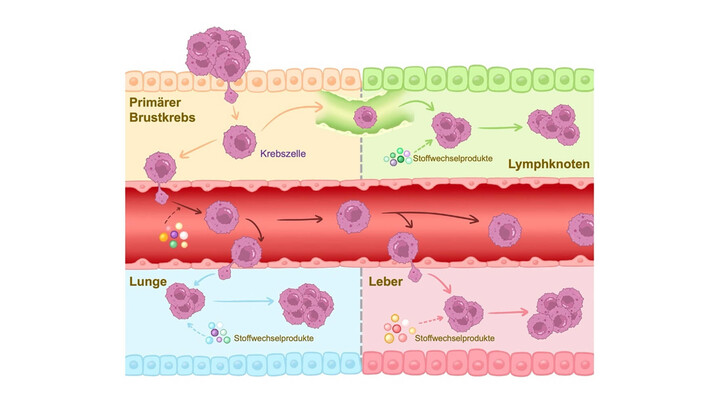
Abbildung 2: Brustkrebs breitet sich entweder mit der Lymphflüssigkeit (lymphogen, grün) oder mit dem Blutfluss (hämatogen, rot) aus. Während dieser Ausbreitung (Metastasierung) kommt die Krebszelle in verschiedenen Organen an, welche unterschiedliche Zusammensetzungen an Stoffwechselprodukten aufweisen. In den Organen angekommen nehmen wir an, dass die verschiedenen Zusammensetzungen einen Einfluss auf das Wachstum der Krebszellen haben.
Ansatz des Forschungsprojektes
Um die Veränderungen des Stoffwechsels während des Krankheitsverlaufs zu untersuchen, erhalten wir Gewebeproben von Krebspatientinnen aus der Frauenklinik (UKW). Aus diesen Proben isolieren wir die Gewebsflüssigkeit zwischen den Zellen, die so genannte interstitielle Flüssigkeit. Diese Flüssigkeit enthält verschiedene Stoffwechselprodukte, die von den Zellen im Gewebe produziert und ausgeschieden werden. Mit Hilfe molekularbiologischer und bioinformatischer Methoden können wir die komplexen Veränderungen des Stoffwechsels und der Kommunikation der einzelnen Zellen im Gewebe aufklären.
Während der Ausbreitung (Metastasierung) stellt jeder potentielle Metastasierungsort mit seinem spezifischen Stoffwechselprofil einzigartige Herausforderungen an die sich ausbreitenden Tumorzellen. Diese ortsspezifischen Stoffwechselprofile können sich zwischen häufigen Metastasierungsorten wie Lymphknoten, Leber, Lunge und Gehirn und seltenen Metastasierungsorten wie der Milz bei Brustkrebs erheblich unterscheiden. Darüber hinaus können Tumore, Infektionen, die Ernährungsweise oder das Altern das Stoffwechselprofil von Organen verändern, um die Aussaat von Tumorzellen zu fördern.
In diesem Projekt wollen wir Gewebeflüssigkeiten mittels Metabolomanalyse (basierend auf Flüssigkeitschromatographie-Massenspektrometrie) auf Veränderungen in wasserlöslichen Stoffwechselprodukten und Lipiden (Fette) untersuchen. Wir wollen Stoffwechselprodukte identifizieren, die die Ansiedlung spezifischer Tumorzellen fördern und diese in Zellkultursystemen weiter testen.
Welche Krebserkrankung soll behandelt werden?
Unsere Forschung beruht auf Brustkrebs der verschiedenen molekularen Subtypen in verschiedenen Krankheitsstadien. Von besonderem Interesse sind für uns metastasierte Brustkrebsfälle.
Warum soll das Forschungsprojekt unterstützt werden?
Eine tolerante Umgebung ist die Voraussetzung für das Überleben und Wachstum von Tumorzellen am Primär- und Metastasierungsort. Gelingt es uns, diese tolerante Umgebung zu verändern, können Tumorzellen schlechter (an)wachsen.
Als junge, internationale Forschungsgruppe sind wir hoch motiviert, diese Wissenslücken durch interdisziplinäre Zusammenarbeit zu schließen. Wir glauben, dass die Identifizierung von Schlüsselmechanismen im Stoffwechselweg der Metastasierung nicht nur das Verständnis der Krankheitsentstehung vertieft, sondern auch die Entwicklung innovativer therapeutischer Ansätze ermöglicht.
