Entwicklung eines Organoid-Modells für neuroendokrine Tumoren (NET)
Dieses Projekt wurde 2024 von der Stiftung "Forschung hilft" mit 10.000 Euro gefördert.

Dr. Alexander Weich betreut als Sprecher des NET-Zentrums am UKW (ENETS CoE) die Patienten mit neuroendokrinen Tumoren. Als ärztlicher Leiter des gastroenterologischen Forschungslabors widmet sich sein multidisziplinäres Team aus Internisten, Nuklearmedizinern und Biologen seit Jahren translationalen Projekten zur Erforschung neuer, Zelloberfächenrezeptor-gerichteter Therapieansätze in neuroendokrinen Tumoren.
Team
Bei dem gastroenterologischen Forschungslabor handelt sich um ein vollausgestattetes S1 Labor, das zusätzlich mit einer abteilungsfinanzierten promovierten Biologin auf einer 60% Hausstelle und zwei erfahrenen MTAs auf je 50% Hausstellen besetzt ist. Verbrauchsmaterialien werden zum Großteil aus der Abteilung für Gastroenterologie finanziert. Weiterhin arbeiten aktuell 2 Medizindoktoranden in unserem Labor an den Projekten mit. Das ENETS-Zentrum ist seit 2016 am Universitätsklinikum Würzburg als "European Neuroendocrine Tumor Society – Center of Excellence" (ENETS CoE) zertifiziert und wurde 2022 mit Bestnote rezertifiziert. Das ENETS CoE umfasst ein multidisziplinäres Team aus allen Fachabteilungen. Das Kernteam des ENETS CoE umfasst:
- OA Dr. A. Weich: Leiter des ENETS CoE und ärztlicher Leiter des gastroenterologischen Labors
- Dr. D. Rogoll: Post-Doc (60%)
- Prof. Dr. M. Scheurlen: Wissenschaftlicher Mitarbeiter / Senior Consultant
- Fr. J. Fischer: Study-Nurse und Patientenlotsin im ENET-Zentrum
- Hr. C. Däubler: Assistenzarzt
- Fr. J. Bayer: Assistenzärztin
- Fr. A. Volk und Fr. K. Backhaus: MTA (jeweils 50%)

Motivation und Innovation
Gastroenteropankreatische neuroendokrine Neoplasien (GEP-NEN) sind eine seltene und heterogene Gruppe von Tumorerkrankungen, die aus unterschiedlichen Organen des menschlichen Körpers hervorgehen können. Die Tumoren wachsen in der Regel langsam und bleiben oft lange Zeit unbemerkt, weshalb sie bei Diagnosestellung häufig bereits metastasiert sind. Eine Heilung durch chirurgische Resektion ist daher oft nicht mehr möglich, und langfristige Systemtherapien der Tumorerkrankung sind notwendig. Einige dieser Tumoren können Hormone im Überschuss produzieren (z.B. Serotonin), was zu schwerwiegenden, den Patienten stark beeinträchtigenden Hormonexzess-Syndromen (z.B. Karzinoid-Syndrom) führen kann.
Zentraler Ansatzpunkt für die Diagnostik und Therapie differenzierter neuroendokriner Tumoren sind die Somatostatinrezeptoren (SSTR) 2a und – zu einem geringeren Anteil – SSTR5. Ein erhaltener Rezeptorbesatz ermöglicht eine Therapie mit kalten Somatostatinanaloga (Lanreotid, Octreotid LAR) oder eine Peptid-Radio-Rezeptor-Therapie (PRRT). In dedifferenzierten NEN wird der CXC motif chemokine receptor 4 (CXCR4) als alternative Zielstruktur diskutiert. Für die präklinische Entwicklung neuer SSTR- oder CXCR4 gerichteter therapeutischer oder diagnostischer Ansätze stellt der Mangel an geeigneten Zellkulturmodellen ein gravierendes Problem dar. Die einzigen allgemein verfügbaren Zellkulturmodelle BON-1 und QGP-1 weisen einen entdifferenzierten Phänotyp auf und haben adäquat hohe SSTR- oder CXCR4- Expression für die präklinische Evaluation rezeptorgerichteter therapeutischer oder diagnostischer Strategien.
Unser Labor hat daher eine neue neuroendokrine Zelllinie aus einem Tumorresektat entwickelt, die aufgrund ausgeprägter SSTR- und CXCR4-Expression geeignet ist, neue rezeptorgerichtete Therapien zu entwickeln.
Weitere herkömmliche präklinische Modelle zur Untersuchung von NEN, wie Monolayer-Zelllinien und xenogene Mäusemodelle, ermöglichen zwar Einblicke in die Pathophysiologie dieser Tumore, haben jedoch begrenzte Relevanz für die klinische Praxis. Diese Modelle können die komplexen Wechselwirkungen zwischen Tumor und umgebendem Gewebe nicht vollständig nachbilden und lassen sich oft schlecht auf die Situation in vivo übertragen. Daher werden wir in unserem Labor eine neue Methode zur Gewinnung von Organoidmodellen etablieren. Solche Modelle gewinnen zunehmend an Bedeutung als vielversprechende präklinische Plattform für die Erforschung von Tumorerkrankungen. Organoidkulturen sind 3D-Zellmodelle, die aus pluripotenten oder adulten Stammzellen gewonnen werden und die Gewebeorganisation und -funktionen des ursprünglichen Gewebes nachbilden können. Durch die Entwicklung von Organoiden aus NEN-Gewebeproben besteht das Potenzial, die Biologie dieser Tumore genauer zu erforschen und präzisere Vorhersagen über ihre Reaktion auf verschiedene Behandlungsansätze zu treffen. Die neue Methode zur Erstellung von Organoidkulturen soll daher zunächst an unserer neuen Zelllinie MS-18 etabliert werden, um ein Organoidmodell zur Evaluation rezeptorgerichteter Therapien zu liefern und die Methode zur Erstellung von Organoiden im Labor zu perfektionieren. Unser Forschungsvorhaben zielt darauf ab aus Patientenbiopsien der klinischen Routine individualisierte, patientenspezifische Tumormodelle zur Evaluation individualisierter onkologischer Therapien zu erstellen.
Das wissenschaftliche, aber auch klinische Interesse an der Entwicklung von, Organoidmodellen aus NET liegt in der Fähigkeit dieser Strukturen, die Komplexität und Heterogenität von NET besser abzubilden und außerdem personalisierte Behandlungsstrategien zu entwickeln. Durch die Nutzung von Patientenbiopsien wollen wir individualisierte Modelle erstellen, welche die spezifischen molekularen und phänotypischen Eigenschaften des Tumors widerspiegeln. Diese patientennahen Organoidkulturen bieten dadurch eine einzigartige Plattform für die Durchführung von Drug Screening-Programmen und die Identifizierung neuer therapeutischer Targets, die darauf abzielen, die Tumorprogression zu hemmen und die Überlebensaussichten der Patienten zu verbessern.
Welche Ziele verfolgt das Projekt?
Unser Forschungsvorhaben zielt darauf ab, die Entwicklung und Anwendung von NET-Organoiden am Standort des ENETS CoE Würzburg am UKW voranzutreiben (s.o), um die personalisierte Medizin bei neuroendokrinen Tumoren und damit die Patientenversorgung zu verbessern.

Ansatz des Forschungsprojektes
Unser Forschungslabor wird, ausgehend von früheren Ergebnissen der Gruppe, die Rolle von Somatostatinrezeptoren (SSTR) und des Chemokinrezeptors CXCR4 in der Pathophysiologie gastroenteropankreatischer neuroendokriner Tumoren (GEP-NETs) weiter erforschen, um neue therapeutische Ansätze zu entwickeln, die auf die Regulation dieser Rezeptoren zielen. Diese Rezeptoren spielen eine wesentliche Rolle bei der Kontrolle von Signalwegen, die Tumorwachstum und Metastasierung von GEP-NETs beeinflussen. Hierfür planen wir die Entwicklung eines Organoid-Modells zunächst aus unserer eigenen Primärzelllinie MS-18 um ein präklinisches Modell zur Evaluation neuer SSTR- und CXCR4-gerichteter Therapiestrategien zu schaffen, und um die Organoidtechnik im gastroenterologischen Forschungslabor zu etablieren, bevor diese an Biopsiematerial aus der klinischen Routine angewendet wird.
Der Mangel an klaren Behandlungsstandards für klinisch aggressive NETs verdeutlicht ebenfalls den Bedarf an präklinischen Modellen, um potenzielle therapeutische Angriffspunkte bei NENs zu testen. Von Patienten gewonnene Tumor-Organoidkulturen (PDTOs) sind dreidimensionale Kulturen von Tumorzellen, die langfristig expandiert werden können und repräsentativ für ihr Ursprungsgewebe sind. Um dieses Ziel zu erreichen, beabsichtigen wir, präklinische Modelle zu verwenden, die die Komplexität und Heterogenität von GEP-NETs besser nachbilden können. Bis heute wurden einige wenige PDTOs aus high-grade NENs, darunter SCLC (kleinzelliges Lungenkarzinom), LCNEC (großzelliges Lungenkarzinom), G3 GEP NETs und NECs (neuroendokrines Karzinom), abgeleitet.
Diese 3D-Zellmodelle, die aus Patientenbiopsien oder -resektaten gewonnen werden, ermöglichen es, die Heterogenität von Tumoren zu erfassen und die individuellen molekularen Merkmale jedes Tumors zu berücksichtigen. Durch die Entwicklung von GEP-NET-Organoiden wollen wir uns in die Lage versetzen, die Interaktionen zwischen Tumor und umgebendem Gewebe genauer zu untersuchen und personalisierte Behandlungsstrategien zu entwickeln. Durch phänotypische Analysen möchten wir zunächst die Ähnlichkeit von NEN-PDTOs zu ihren Ausgangstumoren demonstrieren und nachweisen, dass sie die intratumorale Heterogenität und aktive evolutionäre Prozesse behalten.
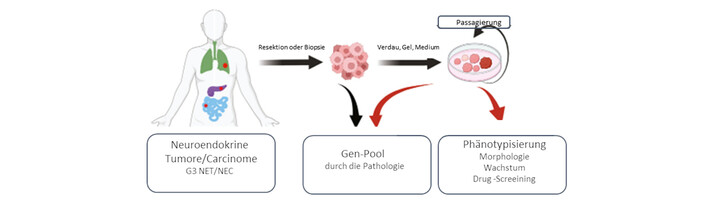
Abbildung: Schema der Gewinnung von PDTOs für NET und NEC, sowie geplante Analysen
Nach erfolgreicher Etablierung sollen die kurzfristigen Organoidkuluren einer Phänotypisierung unterzogen werden. Dabei werden mittels Immunhistochemie (IHC) neuroendokrine Marker wie Chromogranin A, Synaptophysin und CD56/NCAM untersucht. Zusätzlich erfolgen Analysen des Wachstums. Ein weiterer wichtiger Schwerpunkt unseres Forschungsprojekts liegt auf dem Drug Screening. Dabei planen wir, einerseits die Effektivität verschiedener therapeutischer Ansätze zu analysieren, die auf die Regulation von SSTR und CXCR4 abzielen.
Das Personal im gastroenterologischen Forschungslabor wird bei der Etablierung von Organoidkulturen aus NEN und dem Erlernen der Methodik durch den Kooperationspartner Dr. Kai Kretzschmar (Universitätsklinikum Würzburg, Mildred-Scheel Nachwuchszentrum für Krebsforschung – MSNZ) unterstützt und angeleitet. Der Arbeitsgruppenleiter ist ein renommierter Wissenschaftler, der bedeutende Beiträge zur Entwicklung von Organoidmodellen geleistet hat, die eine realitätsnahe Nachbildung von Tumoren ermöglichen. Als durch die der Mildred-Scheel-Stiftung geförderter Wissenschaftler hat er sich intensiv mit der Anwendung und Weiterentwicklung solcher Modelle befasst, um neue Erkenntnisse über die Entstehung und Behandlung von Kieferhöhlentumoren zu gewinnen. Seine Arbeit trägt maßgeblich dazu bei, das Verständnis dieser komplexen Erkrankung zu vertiefen und innovative Therapieansätze zu entwickeln.
Welche Krebserkrankung soll behandelt werden?
Neuroendokrine Neoplasien sind eine heterogene Gruppe von Neoplasien, die vermutlich durch die Schädigung von Stammzellen und spezifischen Vorstufen neuroendokriner Zellen entstehen. Sie können in allen Organsystemen des menschlichen Körpers entstehen, sind aber am weitesten verbreitet im Gastrointestinaltrakt (48%-51%), in der Lunge (25%) und im Pankreas (9%). Neuroendokrine Neoplasien galten lange Zeit als sehr selten, aber mehrere große retrospektive Studien beschrieben in den letzten Jahren eine stetige Steigerung der jährlichen Inzidenz von ca. 1 auf 5-7 pro 100 000 Einwohner in den USA. Heute wird daher vermutet, dass gastroenteropankreatische neuroendokrine Tumoren mittlerweile 2% aller Neoplasien ausmachen und nach dem Kolorektalkarzinom die zweithäufigste Tumorentität im Gastrointestinaltrakt darstellen. Innerhalb der Gesamtheit neuroendokriner Neoplasien sind Neoplasien mit sehr unterschiedlicher Differenzierung und Wachstumsrate enthalten, die daher sehr unterschiedliche Prognose und Therapiemöglichkeiten aufweisen.
Warum soll das Forschungsprojekt unterstützt werden?
Nach der erfolgreichen Etablierung einer neuartigen neuroendokrinen Zelllinie MS-18 als vielversprechendes Modell für die Untersuchung von SSTR und CXCR4 gerichteter diagnostischer und therapeutischer Strategien beabsichtigen wir, einen weiteren Schritt in Richtung patientennaher Forschung zu unternehmen. Es soll eine Methodik entwickelt werden, um aus Tumorresektaten oder -biopsien von Patienten mit NEN Organoidkulturen zu etablieren. Diese von Patienten abgeleiteten Tumor-Organoidkulturen (PDTOs) sollen die komplexen dreidimensionalen Strukturen und Funktionen von GEP-NENs besser abbilden und damit eine Plattform für die Untersuchung von Krankheitsmechanismen und die Entwicklung neuer Therapien bieten.
Mit Hilfe der vorhanden neuroendokrinen Zelllinie kann die Expression von SSTR und CXCR4 und deren Rolle bei der Pathophysiologie von GEP-NENs analysiert werden. Insbesondere die SSTR-Expression ist mit dem Tumorgrad korreliert, wobei eine hohe SSTR-Expression mit einer günstigeren Prognose assoziiert ist. Auf der anderen Seite zeigen neuroendokrine Karzinome (NECs) typischerweise eine niedrigere SSTR-Expression und sprechen weniger gut auf Somatostatinanaloga an. Die Visualisierung der CXCR4-Expression mittels PET/CT kann helfen, dedifferenzierte Tumoranteile zu identifizieren.
Diese Erkenntnisse, die bisher durch die Verwendung von 2D-Zellkulturen gewonnen wurden, sollen nun in komplexen patientenabgeleiteten Tumor-Organoidkulturen (PDTOs) umgesetzt werden, um eine patientennahe Forschung zu ermöglichen. Damit wird eine realitätsnähere Abbildung der Tumorumgebung und -interaktionen erreicht, was dazu beiträgt, die Wirksamkeit potenzieller Therapien genauer zu beurteilen und personalisierte Behandlungsansätze für GEP-NEN-Patienten zu entwickeln.
Die hier beantragte Förderung bei der Stiftung „Forschung hilft“ würde als Anschubfinanzierung dienen, um die Organoidtechnik in unserem Labor anhand der Primärzelllinie MS-18 zu etablieren und SSTR- und CXCR4-gerichtete onkologische Strategien präklinisch zu etablieren. Die hier gewonnenen Erkenntnisse und Fertigkeiten sollen die Basis für großvolumige Drittmittelanträge bilden, um Projekte zu initiieren, in denen die oben genannte Methodik während der Erstbehandlung von Patienten parallel angewendet wird. Durch die direkte Verbindung zur klinischen Behandlung können wir schnell und effizient individuell wirksame Medikamente identifizieren und ihre Wirksamkeit im Rahmen einer individualisierten Behandlung bewerten.
