Neue Angriffspunkte im zellulären Energiestoffwechsel zur Therapie von Leberkrebs

Abbildung 1: Darstellung des Forschungsteams
Team
Das Team des Hepatologischen Forschungslabors der Medizinischen Klinik II am Universitätsklinikum Würzburg (Leitung: PD Dr. rer. nat. Heike Hermanns) erforscht die molekularen Mechanismen von Fettlebererkrankungen und Leberkrebs (Abb. 1). Es ist interdisziplinär aufgestellt und vereint die Expertisen von Medizinern, Naturwissenschaftlern und technischen Mitarbeitern. Das beantragte Projekt soll in Kooperation mit der Abteilung Biochemische Pharmakologie am Institut für Pharmakologie und Toxikologie (Leitung: Prof. Dr. rer. nat. Antje Gohla) neue Arzneistoff-Prototypen gegen in Lebertumoren überaktive Stoffwechselenzyme entwickeln.
Motivation und Innovation
Durch die Entwicklung zielgerichteter Therapien konnte im letzten Jahrzehnt für viele Krebserkrankungen ein Rückgang der Mortalität erreicht werden. Im Gegensatz dazu nehmen die Zahlen für Leberkrebs nach wie vor rasant zu. Ein Hauptgrund dafür ist die steigende Anzahl von Menschen mit starkem Übergewicht und Diabetes mellitus Typ 2. Dies führt oft zu Fettlebererkrankungen, aus denen bei manchen Patienten Leberkrebs entsteht. Einige Formen von Leberkrebs können durch eine Immuntherapie mit sog. Checkpoint-Inhibitoren erfolgreich behandelt werden. Allerdings ist diese Therapie kaum oder gar nicht wirksam, wenn die Tumore durch eine Fettlebererkrankung ausgelöst werden. Daher ist es eine dringende Aufgabe, neue therapeutische Zielstrukturen zu finden, aus denen innovative Behandlungsansätze für diese Patienten entwickelt werden können.
Eine Umprogrammierung des Stoffwechsels ist ein wichtiges Merkmal von Krebs. Eine veränderte Stoffwechselaktivität ermöglicht es Krebszellen, sich schnell zu vermehren und auch unter den für Tumoren typischen variablen Nährstoffbedingungen und Sauerstoffmangel zu überleben. Die veränderte Stoffwechselaktivität dieser Zellen führt jedoch oft zu spezifischen neuen Schwachstellen. Diese können therapeutisch gezielt genutzt werden, um Krebszellen selektiv abzutöten. Vorarbeiten unserer Kooperationspartner haben gezeigt, dass eine veränderte Aktivität des Stoffwechselenzyms PGP (Phosphoglykolat-Phosphatase) zu einer Umprogrammierung des Energiestoffwechsels in Tumorzellen führt. An Patientenmaterial konnten wir daraufhin zeigen, dass PGP in mit Fettleber assoziiertem Leberkrebs überaktiv ist. Eine gesteigerte PGP-Aktivität ermöglicht ein explosives Zellwachstum. PGP könnte daher eine neue pharmakologische Zielstruktur bei Leberkrebs darstellen.
Welche Ziele verfolgt das Projekt?
Das Ziel unseres Projekts ist es, neue Angriffspunkte im zellulären Energiestoffwechsel zur Therapie von metabolisch bedingtem Leberkrebs zu identifizieren. Dies soll durch die komplementäre Expertise unserer Arbeitsgruppe sowie die unserer Kooperationspartner und den Einsatz modernster analytischer Methoden ermöglicht werden.
Ansatz des Forschungsprojektes
In unserem translational ausgerichteten Forschungsprojekt sollen neue metabolische Schwachstellen beim therapieresistenten, aus einer Fettleber entstehendem Leberkrebs identifiziert werden. Diese Schwachstellen entstehen dadurch, dass Leberkrebszellen ihren Energiestoffwechsel verändern müssen, um nach Blockade des Stoffwechselenzyms PGP überleben zu können. Zunächst werden wir die in Leberkrebszellen erhöhte PGP-Expression experimentell mittels CRISPR/Cas9-Technologie ausschalten, und die Situation einer Fettleber durch Nährstoffüberfluss und Entzündungsmediatoren imitieren. Wir werden dann den zellulären Stoffwechsel mittels Massenspektrometrie und Gesamt-Transkriptom-Sequenzierung (RNAseq) charakterisieren. Dies wird aufklären, welche Stoffwechselwege, Stoffwechselprodukte und Gene nach Verlust von PGP verändert werden, um die Lebensfähigkeit der Krebszellen aufrecht zu erhalten. Die erhaltenen Datensätze werden dann nach pharmakologisch angreifbaren Zielstrukturen durchsucht. Falls bereits Arzneistoffe gegen geeignete Zielstrukturen existieren, werden wir diese Substanzen in PGP-defizienten durch Fett- und Zuckerüberschuss gestressten Leberkrebszellen testen. Sollten neue Zielstrukturen identifiziert werden, gegen die noch keine kommerziellen Hemmstoffe existieren, werden wir diese Moleküle durch geeignete Methoden wie z.B. CRISPR/Cas9 ausschalten. Ziel ist es, Wirkstoffkombinationen zu finden, welche die Therapieresistenz von Leberkrebszellen durchbrechen und die Zellen effektiv abtöten (Abb. 2).
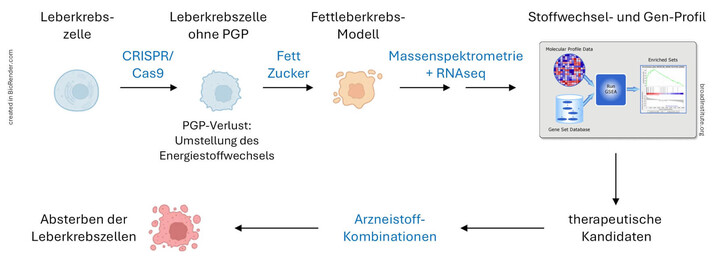
Abbildung 2: Flussdiagramm zur Darstellung des geplanten Verlaufs des Forschungsprojekts. Im Fokus unseres Projektes werden Modelle von metabolisch vermitteltem Leberkrebs stehen. Diese Tumorform nimmt aufgrund des weltweit zu beobachtenden Anstiegs von Übergewicht stark zu.
Welche Krebserkrankung soll behandelt werden?
Unser Forschungsprojekt soll dazu beitragen, die Behandlung von therapieresistentem Leberkrebs zu verbessern.
Warum soll das Forschungsprojekt unterstützt werden?
Die Zunahme von Übergewicht-bedingten Lebererkrankungen erhöht das Risiko für die Entwicklung von Leberkrebs. Leberkrebs gehört weltweit zu den häufigsten Krebs-assoziierten Todesursachen. Auch nach der Einführung von Immuntherapien ist eine effektive Behandlung von mit Fettlebererkrankungen assoziiertem Leberkrebs nur sehr eingeschränkt möglich. Mit unserem Projekt sollen neue Ansätze zur Therapie von behandlungsresistentem Leberkrebs identifiziert und auf ihre klinische Anwendbarkeit hin überprüft werden.
