Schwachstellen von MYC zur Krebstherapie nutzen
Dieses Projekt wurde 2018 von der Stiftung "Forschung hilft" mit 20.000 Euro gefördert.
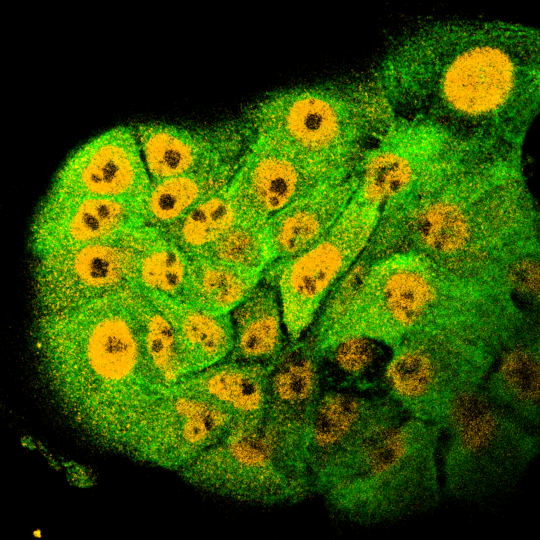
Die Abbildung zeigt Zellen, die mit fluoreszierenden Antikörpern markiert werden. In orange sieht man den Zellkern (wo MYC und ARK5 agieren), in grün das Zytoplasma.
Team
Dr. Giacomo Cossa ist seit 2012 wissenschaftlicher Mitarbeiter in der Arbeitsgruppe von Prof. Dr. Martin Eilers, die aus hochqualifizierten Biologen, Doktoranden, Studenten und technischen Assistenten besteht.


AG Prof. Dr. Martin Eilers; Dr. Giacomo Cossa und Prof. Dr. Martin Eilers
Motivation und Innovation der Arbeitsgruppe
MYC Proteine sind in vielen Krebstypen dereguliert und als eine Konsequenz verantwortlich für den Tod von Millionen Patienten weltweit. MYC spielt eine bedeutende Rolle im Zellkern, wo es die Transkription, einen Schlüsselprozess der Zelle bei dem aus DNA RNA produziert wird, reguliert. Obwohl MYC ein offensichtliches Ziel gegen Krebs ist, ist es aufgrund seiner Struktur sehr schwierig, direkte Hemmstoffe von MYC zu finden. Deshalb entwickeln wir in unserem Labor innovative Strategien, um MYC-getriebene Tumore zu therapieren. In bisherigen Arbeiten konnten wir die Inaktivierung des ARK5 Proteins als eine Schwachstelle dieser Tumore identifizieren. Interessanterweise ist die Inaktivierung von ARK5 toxisch gegen Krebszellen aber nicht für normale Zellen (Liu L et al., 2012). Deshalb sind Medikamente gegen ARK5 eine neue innovative therapeutische Chance, um MYC deregulierte Tumore ohne Nebenwirkungen zu behandeln.
WELCHE ZIELE VERFOLGT DAS PROJEKT?
Das Ziel des Projekts ist die Funktion von ARK5 im Zellkern, wo auch MYC agiert, weiter zu charakterisieren. Tatsächlich ist es wichtig, die Rolle von ARK5 im Zellkern und in der Steuerung der Transkription sowohl in kultivierten Zelllinien (in vitro) als auch im lebendigen Organismus (in vivo) aufzuklären. Mit dieser Kenntnis kann man die Entwicklung ARK5-basierter Therapien gegen Krebs unterstützen.
Durch die Gabe von ARK5 Inhibitoren kann die Dosis von konventionellen Chemotherapien reduziert werden und dadurch typische Nebenwirkungen vermindert werden.
Was ist der Ansatz des Forschungsprojektes?
Mit der Verwendung eines neu entwickelten Inhibitors konnten wir die Rolle von ARK5 im Zellkern und sein Beitrag zur Transkription näher definieren. Wir erwarten, dass man durch diese Erkenntnisse erklären kann, warum die Hemmung von ARK5 eine Schwachstelle von MYC deregulierten Tumoren ist. Das Verstehen der Funktion ist wichtig, um neue Strategien zu entwickeln, um ARK5 in der Behandlung von Krebspatienten nutzen zu können. Ein wichtiger Schritt bevor man neue Behandlungen im Patienten nutzen kann ist neben der Evaluierung in der Zellkultur die Validierung in lebendigen Organismen. Deshalb planen wir gentechnisch veränderte Mäuse zu entwickeln, in denen wir die Expression des ARK5 Proteins manipulieren können. Durch solche Strategien kann man weitere Erkenntnisse in der wesentlich komplexeren in vivo Situation, die näher an der realen Patientensituation ist, analysieren.
Welche Krebserkrankung soll behandelt werden?
Etwa die Hälfte Humantumoren zum Beispiel Brust, Kolon und einige hämatologische Tumoren haben deregulierte MYC Expression. Prinzipiell kann die Entwicklung von ARK5 Inhibitoren daher als Therapieoption für alle solche Tumore genutzt werden. Von aggressiven Kolonkarzinomen weiß man bereits, dass sie von ARK5 abhängig sind.
Warum soll das Forschungsprojekt unterstützt werden?
Wenn sich die bisherigen in vitro Daten bestätigen, sind die potentiellen klinischen Vorteile der ARK5 Hemmung beträchtlich, da sie spezifisch auf Zellen mit deregulierter MYC Expression zielt. Durch die Gabe von ARK5 Inhibitoren kann die Dosis von konventionellen Chemotherapien reduziert werden und dadurch typische Nebenwirkungen vermindert werden.
