„Stark aber sicher!“ – Slow drug release hoch aktiver neuer CD40-Agonisten in der Krebsimmuntherapie
Dieses Projekt wurde 2024 von der Stiftung "Forschung hilft" mit 13.000 Euro gefördert.

Abbildung 1: Das Team der Abteilung für Molekulare Innere Medizin.
Team
Die Abteilung für Molekulare Innere Medizin unter der Leitung von Prof. Dr. rer. nat. Harald Wajant besteht aus promovierten Biologen, medizinischen und naturwissenschaftlichen Doktoranden, sowie technischen Assistenten. Frau Dr. rer. nat. Isabell Lang (vorne Mitte) leitet den Arbeitskreis „Therapeutische Fusionsproteine und Antikörper“.
Motivation und Innovation
Unsere Forschergruppe beschäftigt sich mit wichtigen Signalmolekülen des Immunsystems: den Rezeptoren und Liganden der Tumornekrosefaktor (TNF)-Superfamilie. Eine Gruppe von immunstimulatorischen TNF-Rezeptoren sitzen beispielsweise in der Zellwand von Immunzellen, die in das Tumorareal einwandern. Diese Rezeptoren können durch ihre spezifischen Liganden oder agonistische Antikörper nach dem Schlüssel-Schloss-Prinzip aktiviert werden. Der Arbeitskreis widmet sich der Fragestellung, wie man solche TNF-Rezeptoren gezielt im Tumor bzw. im Tumormikromilieu aktivieren kann, um bevorzugt die Immunzellen im Tumorareal zur Bekämpfung der Krebszellen zu stimulieren. Dabei liegt der Fokus zum einen auf der Entwicklung neuer therapeutischer Antikörperformate und zum anderen auf deren sicheren und effektiven Darreichung.
„Auch neue effektive Medikamente können nur solange helfen, wie der Krebspatient die Therapie ertragen und durchstehen kann. Das darf man nicht vergessen und deshalb müssen wir nicht nur am Wirkstoff selbst, sondern auch an der sicheren Anwendung arbeiten!“
– Dr. rer. nat. Isabell Lang
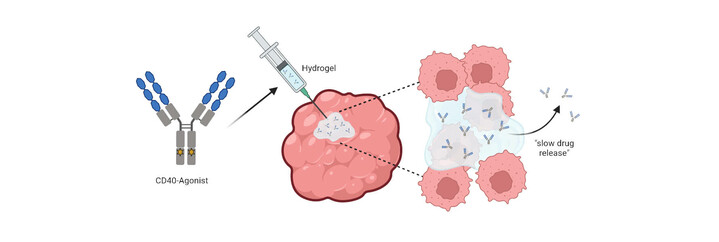
Abbildung 2: Schema der intratumoralen Applikation neuer CD40-Agonisten und der langsamen lokalen Wirkstofffreisetzung. Erstellt mit Biorender.
Welche Ziele verfolgt das Projekt?
Das therapeutische Zielmolekül in unserem Projekt ist der Rezeptor CD40. CD40 ist ein Mitglied der Tumornekrosefaktor (TNF)-Rezeptor-Superfamilie und wird von Antigen-präsentierenden Zellen wie dendritischen Zellen, Makrophagen und B-Zellen exprimiert, ist aber auch auf nicht-hämatopoetischen Zelltypen wie Endothelzellen, Fibroblasten und glatten Muskelzellen zu finden. CD40 wird durch den CD40-Liganden (CD40L oder auch CD154) stimuliert, einem Transmembranprotein, das der TNF-Superfamilie angehört. CD40L wird hauptsächlich von aktivierten CD4+ T-Zellen exprimiert. T-Helferzellen aktivieren mittels CD40L den CD40 auf Antigen-präsentierenden Zellen und stimulieren auf diese Weise unter anderem die Bildung von Keimzentren in lymphatischen Geweben, den Wechsel der Antikörperklasse, aber auch die Differenzierung und Reifung von dendritischen Zellen und die phagozytische Aktivität von Makrophagen.
Die Stimulation des CD40-Moleküls gilt seit mehr als zwei Jahrzehnten als vielversprechende Therapiestrategie in der Krebsimmuntherapie. Bisher sind CD40-aktivierende Reagenzien jedoch nicht für die Tumorbehandlung zugelassen. Klinische Studien mit CD40-stimulierenden Reagenzien zeigten entweder ein gutes Sicherheitsprofil, aber dafür eine begrenzte antitumorale Aktivität oder führten zu starken Nebenwirkungen, d.h. zu einer dosislimitierenden Toxizität z.B. aufgrund des Zytokin-Freisetzungssyndroms oder Lebertoxizität.
Präklinische Studien haben gezeigt, dass die intratumorale und systemische Anwendung von CD40-Agonisten eine vergleichbare therapeutische Wirksamkeit haben, die lokale Applikation im Tumor jedoch mit weniger Nebenwirkungen verbunden ist und dadurch „sicherer“ und effektiver ist. Es ist anzunehmen, dass die Nebenwirkungen in klinischen Studien das Erreichen klinisch wirksamer Dosen von CD40-Agonisten bisher verhindert haben oder zumindest die maximal mögliche Wirksamkeit antitumoraler CD40-vermittelter Aktivitäten im Tumormikromilieu nicht zulassen.

Abbildung 3: Technische Assistentin bei der Produktion und Aufreinigung neuer hoch aktiver CD40-Agonisten.
Ansatz des Forschungsprojektes
Die allermeisten präklinischen und klinischen Studien, die das immuntherapeutische Potenzial der CD40-Aktivierung für die Tumorbehandlung untersuchen, zielten auf die Ausnutzung des CD40-agonistischen Potenzials von anti-CD40-Antikörpern. Letztere wirken letztendlich jedoch als duale Agonisten, d.h. sie aktivieren auch sogenannte Fcγ-Rezeptoren (FcγR) auf Immunzellen. In der Regel ist es dabei sogar so, dass anti-CD40-Antikörper CD40 dann besonders stark aktivieren, wenn sie gleichzeitig an FcγRs gebunden haben, und FcγRs wiederum besonders effizient aktiviert werden, wenn die Antikörper an zellständiges CD40 gebunden haben. Die Aktivierung von FcγRs kann dann wiederum zu Nebenwirkung führen und/oder zur unerwünschten Zerstörung der CD40-exprimierenden Immunzellen durch ADCC, d.h. durch antikörperabhängige zellvermittelte Toxizität. Wir haben die Mechanismen der CD40-Rezeptor-Aktivierung durch Antikörper im Detail untersucht und konnten „starke“ neue CD40-Agonisten auf Basis von sogenannten Nanobodies, einer speziellen Art von Antikörperdomänen, die besonders stabil und gut produzierbar sind, generieren. Diese Nanobody-CD40-Agonisten binden nicht an FcγRs, sind aber dennoch hochaktiv, und verhindern so die mit der Bindung an FcγRs assoziierten Nebenwirkungen. Die verbleibenden direkt mit einer systemischen Aktivierung von CD40 einhergehenden Nebenwirkungen können durch eine intratumorale Anwendung reduziert werden.
Die intratumorale Applikation von CD40-Agonisten (oder anderen Medikamenten) klingt zunächst nach einer vergleichsweise einfachen und wirksamen Möglichkeit, Nebenwirkungen zu reduzieren. In der klinischen Praxis stellt diese Behandlungsstrategie jedoch eine komplexe Option dar, weil der Eingriff als solcher technisch anspruchsvoll ist. Außerdem können die Antikörper trotz lokaler Applikation in den Blutkreislauf gelangen, dort aufgrund ihrer langen Serumhalbwertszeit über einen längeren Zeitraum zirkulieren und so die ungewollte CD40-Signalübertragung außerhalb des Tumors auslösen. Obwohl die intratumorale Applikation von agonistischen CD40-Antikörpern es erlaubt höhere Wirkspiegel zu erreichen, begrenzen auch hier die systemischen Nebenwirkungen die einsetzbare Menge an CD40-Agonisten. Die Antikörperfreisetzung aus dem Tumor wiederum variiert auch erheblich mit der makroskopischen Tumorstruktur. Dementsprechend erfordert die intratumorale Applikation von CD40-Antikörpern derzeit mehrere, teilweise > 10 Injektionen/Eingriffe, was hinsichtlich der Patientencompliance und der klinischen Organisation eine große Herausforderung darstellt.
Hier kommt unser zweiter Projektansatz ins Spiel: Der „Slow drug release“ unserer neuen CD40-Agonisten, d.h. die langsame „sichere“ Wirkstofffreisetzung gezielt im Tumor über einen längeren Zeitraum. Die Idee dahinter ist es die Nanobody-CD40-Agonisten in Hydrogelkörpern in den Tumor zu applizieren, welche die Nanobodykonstrukte nur langsam freisetzen. Eine aktuelle Studie konnte zeigen, dass solch ein Hydrogel-Depot in der Lage ist immunstimulatorische konventionelle CD40-Agonisten unter Beibehaltung der Wirksamkeit langsam freizusetzen. Es ist also möglich bei der Applikation bzw. bei der Beladung des Medikamenten-Depots zu steuern, wann und wie lange die Antikörper im Tumor wirken sollen. Wir möchten nun in enger Kooperation mit Arbeitsgruppen des SFB / TRR 225 (Biofabrikation) derartige Hydrogele weiterentwickeln und optimieren, die uns eine gerichtete Applikation und Freisetzung unserer neuen hoch aktiven CD40-Nanobody-Agonisten erlauben.
Welche Krebserkrankung soll behandelt werden?
Unsere neuen CD40-Agonisten und vor allem der Einsatz von Hydrogelen für die intratumorale Injektion können für unterschiedlichste Tumorentitäten eingesetzt werden und können somit vielen Krebspatienten von Nutzen sein.
Warum soll das Forschungsprojekt unterstützt werden?
Das beantragte Forschungsprojekt soll dabei helfen einen erfolgversprechenden immuntherapeutischen Ansatz, nämlich die Aktivierung von CD40, für die mögliche Anwendung im Krebspatienten sicherer und daher anwendbarer zu machen. Die Therapie wird durch unsere neuen innovativen unabhängig von FcγRs wirksamen CD40-Agonisten spezifischer. Von der Darreichungsform über Hydrogel-Depots erhoffen wir uns gleichzeitig deutlich weniger CD40-assoziierte Nebenwirkungen für den Patienten. Die potenzielle Anwendungsmöglichkeit kann darüber hinaus auf die Therapie verschiedenster Krebsarten übertragen werden bzw. kann die Wirkstoffart individuell angepasst werden. Immer getreu unserem Motto: „Stark aber sicher!“
