Untersuchung der RAS-Inhibition für die Translation in die Therapie des Multiplen Myeloms

Abbildung 1: Dr. med. Dr. rer. nat. Torsten Steinbrunn
Team
Meine Arbeitsgruppe befindet sich aktuell im Aufbau, nachdem ich im März 2025 von einem dreijährigen Forschungsaufenthalt in Boston nach Würzburg zurückgekehrt bin. Dort habe ich eine neue Methode der funktionellen Genomik erlernt, sog. CRISPR-Screens, die ich hier ebenfalls etablieren möchte, um Resistenzmechanismen zu verstehen, die im Rahmen einer Myelomtherapie, z.B. mit RAS-Inhibitoren, entstehen.
Motivation und Innovation
Seit meiner MD/PhD-Ausbildung fahre ich zweigleisig – als Kliniker und als Wissenschaftler, stets an der Schnittstelle zwischen klinischen Fragestellungen und molekularbiologischen Umsetzungen im Labor. Mein wissenschaftlicher Fokus lag und liegt auf der funktionellen Charakterisierung von molekularen Zielstrukturen für die Therapie des Multiplen Myeloms. So konnte ich bereits etliche Jahre vor der Entwicklung pharmakologischer RAS-Inhibitoren mit Hilfe von Gen-Knockouts die Abhängigkeit von Myelomzellen von onkogenen RAS-Mutationen aufzeigen und nachgeschaltete Signalkaskaden darstellen. In den letzten drei Jahren hatte ich die außerordentliche Gelegenheit, mich in Boston in die Methode der CRISPR-Screens einzuarbeiten. Während über bisherige genomweite Sequenzierungsprogramme unser Wissen zu genomischen Veränderungen in Myelomzellen geradezu explodierte, können mit Hilfe dieser Screens funktionelle Auswirkungen dieser genetischen Veränderungen auf genomweiter Basis untersucht werden. Dies macht zum einen wissenschaftlich faszinierende Erkenntnisse z.B. zu Resistenzmechanismen möglich, birgt zum anderen aber vor allem ein ungeheures Potential für das Verständnis von therapeutisch nutzbaren Angriffspunkten, um diese Erkrankung von mehreren Richtungen aus zu behandeln.
Welche Ziele verfolgt das Projekt?
Ziel A:
Aufbauend auf meinen erfolgversprechenden Vorarbeiten zu RAS-Inhibitoren in vitro und in vivo sollen zum Zweck der klinischen Translation primäre Myelomproben von Würzburger Myelompatienten auf ihr Ansprechen auf RAS-Inhibition in Abhängigkeit von ihrem KRAS- oder NRAS-Status getestet werden. Die Zellen werden aus Knochenmarkproben aufgereinigt und mit RAS-Inhibitoren behandelt. Gleichzeitig soll durch Kokultur mit Knochenmarkstroma dessen Einfluss auf die Wirksamkeit der RAS-Inhibition untersucht werden. Der RAS-Status wird durch Amplicon-Sequenzierung bestimmt. Diese Untersuchungen sind zielführend für die Abschätzung, wie aussichtsreich die klinische Anwendung der zielgerichteten RAS-Therapie sein wird.
Ziel B:
Aufbauend auf der in Boston erlernten Methodik der funktionellen genomweiten CRISPR-Screens sollen die Voraussetzungen geschaffen werden, diese Methode in Würzburg ebenfalls in vitro und in vivo anzuwenden. Hiermit soll die Entstehung Resistenzmechanismen gegen die zielgerichtete Therapie (z.B. mit RAS-Inhibitoren) untersucht werden mit dem Ziel, Strategien zu finden, diese zu umgehen. Dafür werden durch diese high throughput-Methode Gene identifiziert werden, die als Targets für eine Kombinationstherapie fungieren können.
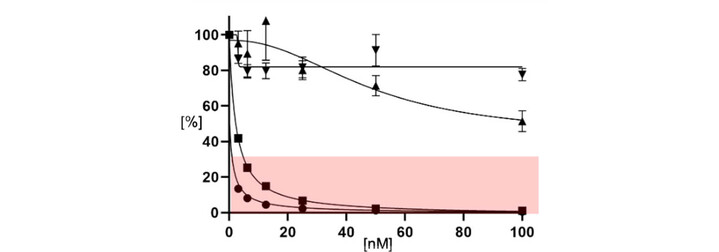
Ansatz des Forschungsprojektes
Die Therapie des Myeloms hat sich in den letzten 20 Jahren erheblich verbessert, gleichwohl ist die Hochdosistherapie mit autologer Stammzelltransplantation noch immer das Verfahren der Wahl. Eine zielgerichtete Therapie, wie sie z.B. bei der CML oder bei soliden Tumoren wie dem Lungenkarzinom zum Standard zählt, existiert bislang nicht, hauptsächlich deshalb, weil die „richtige“ Zielstruktur fehlt. Nach Jahrzehnten von Fehlschlägen ist es vor Kurzem erstmals gelungen, spezifische Inhibitoren gegen das RAS-Protein zu entwickeln. Dieses RAS-Protein ist in vielen Tumoren, darunter dem Myelom, mutiert und wird dadurch zum onkogenen Treiber der Erkrankung.
In meinen Vorarbeiten in Boston konnten ich anhand von in vitro- und in vivo-Modellen mit Myelom-Zelllinien zeigen, dass die zielgerichtete Inhibition von onkogenem RAS das Wachstum von Myelomzellen aufhält. Dies konnte ich nachweisen für (i) spezifische KRAS-Inhibitoren gegen die G12C- und G12D-Mutation; (ii) pan-KRAS-Inhibitoren, die etwas breiter gegen onkogen aktiviertes (pan-)KRAS gerichtet sind; (iii) sog. RAS-ON-Inhibitoren, die über eine spezifische Komplexbildung sowohl aktiviertes KRAS als auch NRAS hemmen können. Letztere sind für die Therapie des Multiplen Myeloms von besonderem Interesse, da jeweils ca. 25% der Myelomfälle KRAS- bzw. NRAS-mutiert sind, das bedeutet, dass für die Hälfte der Myelompatienten diese Therapiestrategie erfolgversprechend ist. Aus Erfahrungen in soliden Tumoren wissen wir, dass diese Therapie gut verträglich und daher auch für Patienten möglich ist, für die intensive Therapien wie Hochdosis oder CAR-T-Zelltherapie nicht geeignet sind.
In Würzburg habe ich nun die Möglichkeit, diese Erkenntnisse so nah wie möglich an die klinische Translation zu bringen, indem ich dieses zielgerichtete Wirkprinzip an primären Myelomproben von Würzburger Myelompatienten testen kann. Hierbei wird die Wirksamkeit der Therapie mit dem KRAS- und NRAS-Mutationsstatus korreliert und gleichzeitig der Einfluss des Knochenmarkstromas berücksichtigt. Nur so kann abgeschätzt werden, wie gut diese Therapie im klinischen Einsatz funktionieren wird.
Parallel dazu möchte ich verstehen, welche Mechanismen zur Resistenzbildung führen, die sich unweigerlich im längeren Verlauf der Therapie einstellt. Hierzu werde ich die Methode der genomweiten funktionellen CRISPR-Screens, die ich in Boston lernen durfte, für in vitro- und perspektivisch auch in vivo-Modelle etablieren. Hierbei lassen sich Gene und Gengruppen identifizieren, die die Wirksamkeit der zielgerichteten Therapie verstärken oder abschwächen, die Resistenzbildung ursächlich fördern und somit als potentielle weitere Zielstrukturen für eine Kombinationstherapie dienen.
Welche Krebserkrankung soll behandelt werden?
Aufgrund meiner langjährigen Erfahrung in der Myelomforschung möchte ich dieses Projekt zur translationalen Evaluierung der RAS-Inhibition auf die Erkrankung Multiples Myelom fokussieren. Die Entwicklung der funktionellen Genomik-Screens soll ebenfalls zunächst an Myelommodellen stattfinden und nach erfolgreicher Etablierung auch für andere hämatoonkologische Entitäten verfügbar sein. Insbesonders sind hier künftige translationale Projekte für die AML zu nennen, wofür eine Kollaboration mit der Arbeitsgruppe von Frau PD Dr. Sabrina Kraus vom Zentrum für allogenen Stammzelltransplantation besteht.
Warum soll das Forschungsprojekt unterstützt werden?
Die Fragestellungen rund um die zielgerichtete Therapie mit RAS-Inhibitoren sind ein brandaktuelles Thema, das insbesondere in der soliden Onkologie bereits erfolgreich in der klinischen Anwendung gebracht wurde. Auch in den hämatologischen Entitäten wird hier aktuell intensiv geforscht und besonders die RAS-ON-Inhibitoren besitzen ein enormes Potential für die klinische Translation.
Der Aufbau meiner Forschungsgruppe neben der klinischen Tätigkeit ist allerdings eine zeitintensive Arbeit, in der Abkürzungen aufgrund der umfangreichen Antragsverfahren kaum möglich sind. Die Förderung durch die Stiftung „Forschung hilft“ würde es mir daher ermöglichen, bereits jetzt ohne lange Vorlaufzeit mit den ersten Projekten „durchzustarten“ und die relevanten (und kompetitiven) Fragestellungen auf den Weg zu bringen. Die Aufreinigung der Patientenproben wird in Kollaboration mit der Arbeitsgruppe von Herrn Prof. Martin Kortüm durchgeführt, mit der Methode habe ich selbst jahrelange Erfahrung und ich bin daher für das beschriebene Projekt bereits jetzt „startklar“.
Für den geplanten Aufbau der CRISPR-Screen sollen hier nur die Vorarbeiten abgebildet werden, d.h. die Klonierung der genomweiten Plasmide, die Anpassung und Optimierung der Transduktionsprotokolle, die Kalibrierung der PCR-Reaktionen sowie die Testsequenzierungen der Plasmide. Die eigentliche Anwendung der Methode soll im Rahmen von eigenständigen Projekten stattfinden, für die ich mich ebenfalls um extramurale Förderung einschließlich Personalstellen bei verschiedenen Drittmittelgebern bewerbe.
