Verbesserung der Immuntherapie durch gezielte Manipulation von Lymphknoten-Makrophagen

Abbildung 1: Mitglieder der AG Riedel, Angela Riedel (AG Leiterin, vorne links) aus dem Mildred-Scheel-Nachwuchszentrum für Krebsforschung (UKW)
Team
Die Arbeitsgruppe von Dr. Angela Riedel am Mildred-Scheel-Nachwuchszentrum für Krebsforschung (UKW) beschäftigt sich mit der zellulären Kommunikation von Krebszellen innerhalb ihrer Nische – also ihrer unmittelbaren Umgebung. Dazu gehört für uns auch der tumor-drainierende oder Sentinel-Lymphknoten, da er dem Tumor direkt nachgeschaltet ist. Ein Schwerpunkt liegt auf der Untersuchung der Auswirkungen von Tumortherapien auf die Nische und der Frage, wie diese zu Therapieresistenzen beitragen kann.
In diesem Projekt untersucht die Nachwuchswissenschaftlerin Ana Cetkovic (Doktorandin, AG Riedel) die Mechanismen, die zur Resistenz gegen Immun-Checkpoint-Inhibitoren bei Melanom- und Brustkrebspatienten beitragen. Das Verständnis der komplexen zellulären und molekularen Determinanten der Therapieresistenz ist von grundlegender Bedeutung für die Optimierung von Behandlungsstrategien. Das internationale Team arbeitet eng mit der Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie mit der Arbeitsgruppe von Prof. Dr. Astrid Schmieder und mit der Frauenklinik unter der Leitung von Prof. Dr. Wöckel zusammen. Der intensive Austausch mit den Ärzten der Kliniken gibt ihnen die einzigartige Möglichkeit, unsere Ergebnisse translational zu diskutieren.
Motivation und Innovation
Die Einführung von Immun-Checkpoint-Inhibitoren, wie z. B. der anti-PD1 gerichteten Therapie, stellt einen bedeutenden Fortschritt in der Behandlung von Melanom und triple-negativem Brustkrebs dar. Für die Entwicklung dieser Wirkstoffe wurden ihre Entwickler 2018 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet. Doch trotz hoher Ansprechraten von bis zu 50 % profitieren viele Patienten nicht von der Therapie oder sind mit belastenden Nebenwirkungen konfrontiert. Die zugrunde liegenden Mechanismen der intrinsischen Therapieresistenz sind bisher aber nur unzureichend verstanden.
Allerdings gibt es Hinweise darauf, dass tumor-drainierende oder Sentinel-Lymphknoten eine Schlüsselrolle bei der Immun-Checkpoint-Inhibitor-induzierten Tumorregression spielen. Unsere Forschungsergebnisse zeigen, dass Lymphknotenmakrophagen, eine bestimmte Immunzellpopulation im Lymphknoten, eine wichtige Rolle in diesem Prozess zukommt, indem sie ihren Phänotyp vor und während einer Anti-PD1-Therapie verändern.
Wir stellen daher die Hypothese auf, dass Lymphknoten-Makrophagen bei der Anti-PD1-Therapie eine Rolle bei der Wirksamkeit spielen und dass eine gezielte Beeinflussung dieser die Effektivität verbessern könnte. Wir möchten daher unsere Vordaten in tumor-drainierenden Lymphknoten von Melanom- und Triple-negativen Brustkrebspatienten verifizieren und Kulturmodelle und Strategien etablieren, um Lymphknotenmakrophagen therapiefördernd umzuprogrammieren.
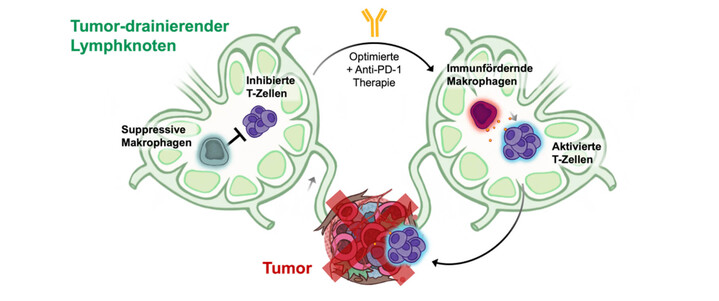
Abbilung 2: Tumor-drainierende Lymphknoten werden im prämetastatischen Stadium umprogrammiert und schaffen eine immunsuppressive Mikroumgebung und eine tumorfreundliche Nische für Krebszellen. Die gezielte Beeinflussung dieser Immunitätsnische kann T-Zellen reaktivieren und in Kombination mit einer Anti-PD-1-Therapie wirksame Immunreaktionen hervorrufen, die zu einer effizienteren Abtötung von Tumorzellen führen könnte.
Welche Ziele verfolgt das Projekt?
Wir wollen verstehen, wie sich die komplexe tumor-drainierende Lymphknotennische bei Melanom- und Brustkrebspatienten verändert und zur Wirksamkeit oder Resistenzentwicklung der Anti-PD1-Immuntherapie beitragen kann. Wir glauben, dass ein zielgerichteter Ansatz, insbesondere die Reprogrammierung der Lymphknoten-Makrophagen durch sogenannte Lipid-Nanopartikel in Kombination mit einer Anti-PD1-Immuntherapie, das Ansprechen der Patienten verbessern könnte.
Ansatz des Forschungsprojektes
Lymphknoten sind sekundäre lymphatische Organe, in denen unsere Immunantwort initiiert wird. Leider sind sie bei Krebspatienten auch häufig von Metastasen betroffen, was meist eine schlechte Prognose zur Folge hat. Diese tumor-drainierenden Lymphknoten haben aber auch eine Bedeutung beim Ansprechen auf Therapien. Insbesondere konnte nachgewiesen werden, dass sie bei der Anti-PD1-Therapie eine Rolle spielen. Wir konnten zeigen, dass der Lymphknoten häufig immunsupprimiert ist, also bereits vor der Metastasierung durch den Tumor verändert wird. Er beherbergt dann myeloide Zellen wie Makrophagen, die eine hohe Expression von PD-L1, dem Liganden für PD1, aufweisen. PD1 ist ein Rezeptor auf T-Zellen und steht für programmed death 1. Nach Aktivierung des Rezeptor-Liganden führt dieser jedoch zur Inaktivierung der T-Zellen. Dies soll durch die Gabe von Anti-PD1-Immuntherapien verhindert werden, damit die T-Zellen wieder zur Kontrolle des Tumors beitragen können. Sind Zellen vorhanden, wie z.B. in den oben erwähnten Lymphknoten, die eine hohe Expression von PD-L1 aufweisen, können diese T-Zellen stark inaktivieren.
Die Makrophagen in den Lymphknoten verändern sich jedoch nicht nur durch eine aggressive Tumorerkrankung, sondern bei therapieresistenten Tumoren auch unter einer Anti-PD1-Immuntherapie.
In diesem Projekt wollen wir unsere bisherigen Daten an Lymphknotenbiopsien von Melanom- und Triple-negativen Brustkrebspatientinnen mit und ohne Anti-PD1-Immuntherapie mittels Immunfärbungen und Einzelzellsequenzierung verifizieren. Außerdem wollen wir Lymphknoten-Makrophagen-Kultursysteme entwickeln, in denen wir neuartige Medikamente, sogenannte Lipid-Nanopartikel, testen. Diese sollen genutzt werden, um die immunsuppressive - also immunhemmende - Wirkung in eine proinflammatorische - also immunfördernde - Wirkung der Makrophagen umzuprogrammieren.
Welche Krebserkrankung soll behandelt werden?
Unsere Forschung konzentriert sich auf die Anwednung von Immun-Checkpoint-Inhibitoren bei der Behandlung von Melanom und triple-negativem Brustkrebs.
Warum soll das Forschungsprojekt unterstützt werden?
Mit der Einführung der Immun-Checkpoint-Inhibitor-Therapie wurde ein wichtiger Durchbruch bei der Behandlung von Krebs erzielt. Zu verstehen, warum manche Patienten nicht auf die Therapie ansprechen, ist von größter Bedeutung, um Therapieresistenzen zu überwinden, ein lang anhaltendes Ansprechen zu bewirken und das Gesamtüberleben zu verbessern.
Diese Wissenslücken wollen wir als engagierte, junge und internationale Forschungsgruppe durch interdisziplinäre Zusammenarbeit schließen. Wir glauben, dass die Identifizierung der wichtigsten zellulären Mechanismen innerhalb von tumor-drainierenden Lymphknoten, die die Therapieresistenz vorantreiben, eine einzigartige Gelegenheit für die Entwicklung und die erleichterte klinische Umsetzung von gezielten therapeutischen Strategien bieten wird.
